www.fluorescencemicroscopy.it
Menu principale:
- Home Page
- I Microscopi
- Fluorescenza
- Descrizione
- Diascopia
- Epi-Fluoresc.
- Illuminazione
- Installing and Aligning a Mercury Lamp
- I Fluorocromi
- Tabella dei Fluorocromi
- Il Fading
- Lunghezze d'onda
- Proprietà
- Percentuale di Trasmissione
- Tipo di Filtri
- Sovrapposizione di banda
- Intensità del segnale
- Acquisizione di immagini
- Il set di filtri
- I Filtri
- Preparazione dei Fluorocromi
- Preparazione dei campioni
- Preparati in Fluorescenza
- Fluorescenza in Citochimica
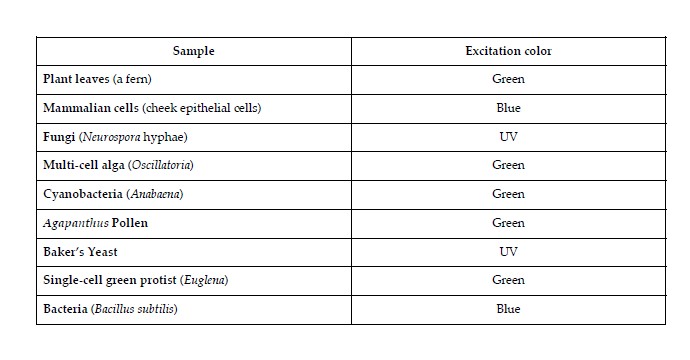
- Autofluorescenza
- Immagini
- Contrasto di Fase
- Polarizzazione
- Campo Scuro
- DIC
- COL
- Rheinberg
- Campo chiaro
Preparati in Fluorescenza
Fluorescenza
Preparati in Fluorescenza
Cellule epiteliali della guancia
Usare uno stecchino di legno e delicatamente raschiare la parte interna della guancia. Applicare le cellule epidermiche estratte in una piccola goccia d' acqua, aggiungere il colorante fluorescente.
Tampone faringeo
Utilizzare una bacchetta per prelevare alcune cellule dal palato. Applicare il campione ad una piccola goccia di soluzione acqua/colorante su un vetrino da microscopio. Applicare un vetrino coprioggetto e fissare con smalto per unghie.
Foglia di Elodea
Questa pianta di acquario comune è un esempio eccellente per la microscopia ottica. Le cellule contengono una gran quantità di fili citoplasmatici, nuclei e organelli visibili. Inoltre, vi è una ricca popolazione di epifite che cresce sulla superficie della foglia. Posizionare delicatamente una foglia in una piccola goccia d'acqua o fluorocromo su un vetrino da microscopio. Per la colorazione della parete cellulare è sufficiente l’immersione per 5 sec in Hexane, ciò aiuta la penetrazione del colorante.
Piante
Utilizzare una lama di rasoio per tagliare piccole sezioni di materiale vegetale. Le sezioni devono essere < 3mm per lato, e le più sottili possibile. Un campione comune è l'epidermide interna della cipolla. Tagliare una profonda superficie quadrata in una cipolla, tirare fuori tre strati (foglie di stoccaggio), tagliare un piccolo quadrato sulla superficie della foglia interna. Prelevare con una pinza e mettere immediatamente in una goccia d'acqua con colorante.
Preparati microbiologici
E’ sufficiente posizionare il campione raccolto in una piccola goccia d'acqua o colorante fluorescente. Possibili metodi di raccolta :
- campione di terreno
- campione in superficie (con stuzzicadenti o nastro)
- campioni dai scarichi del lavello
- tamponi faringei dalla lingua
- campioni di tartaro dei denti
- yogurt o formaggio. Buona fonte di microrganismi Lactobacillus acidophilus , L. bulgaricus e Streptococcus thermophilus.
- ProGreens (miscela di batteri e cianobatteri). Mescolare con acqua , incubare > 1h , centrifuga.
Test dei preparati
TEST DI CONTAMINAZIONE BATTERICA DEI LIQUIDI
Per il test di contaminazione batterica dei liquidi deve essere utilizzato un filtro usa e getta. Il campione viene inserito in una siringa . La soluzione acquosa con batteri putativi viene spinta attraverso un piccolo (13 mm) filtro di vetro di 0.2ìm, che cattura i batteri, supportato da un filtro di carta più grande. Il filtro di vetro " Anodisc " viene recuperato e montato su un vetrino per microscopio . E ' abbastanza piccolo da stare sotto un microscopio coprioggetti standard di 22 millimetri quadrati. I batteri saranno colorati con il colorante fluorescente acido nucleico SYTOBC per renderli visibili sulla superficie del filtro.
IDENTIFICAZIONE DEI BATTERI IN SUPERFICIE
L’identificazione dei batteri in superficie è una procedura che può essere eseguita rapidamente e facilmente utilizzando sonde fluorescenti precedentemente discussi. La procedura generale è quello di determinare la fluorescenza intrinseca della superficie in questione, scegliendo un colorante con uno spettro di fluorescenza che differisce dallo sfondo. Sonda il campione con SYTO BC per localizzare i batteri al microscopio a fluorescenza.
DETERMINAZIONE DELLA VITALITA’ BATTERICA UTILIZZANDO IL MICROSCOPIO A FLUORESCENZA
La vitalità cellulare batterica può essere determinata mediante la microscopia a fluorescenza, ciò avviene perché, nelle cellule viventi, alcuni coloranti sono esclusi dalla membrana cellulare esterna intatta. Possono essere usati due coloranti per DNA: Syto e ioduro di propidio ( PI ) per determinare lo stato della membrana plasmatica, e quindi, se le cellule sono vive o morte . Entrambi i coloranti entrano in una cellula morta (avente una membrana spezzata o assente), mentre PI è escluso dalla membrana di una cellula vivente. SYTO attraversa liberamente la membrana e colora il DNA nelle cellule viventi. Se utilizzati in combinazione, le cellule viventi emettono fluorescenza verde perché sono “marcate” solo con SYTO, mentre le cellule morte emettono fluorescenza rossa quando “marcate” da entrambi i coloranti . La fluorescenza rossa di PI estingue la fluorescenza verde di SYTO.
COLORAZIONE DELL’ENDOSPORA BATTERICA
Alcuni generi di batteri ( Bacillus , Clostridium ) sviluppano endospore resistenti durante i periodi di stress ambientale. Queste spore sono altamente resistenti all'essiccamento e ai danni dell’UV, e, per questo, esse sono anche resistenti agli usuali metodi di colorazione in fluorescenza. Allo scopo può essere utilizzato un metodo adattato per esperimenti citologici nelle piante alfine di modificare la parete cellulare dell’endospora sufficientemente per introdurre il colorante fluorescente Arancio di Acridina.
Indicatore fluorescente della vitalità-Calceina AM o fluoresceina DIACETATO
Calceina AM e fluoresceina diacetato ( FDA) sono coloranti non fluorescenti e membrana permeabili che possono essere introdotti nelle cellule mediante incubazione. Una volta all'interno delle cellule esse vengono idrolizzati da esterasi endogeno (più ATP ) nella carica negativa della calceina fluorescente o fluoresceina. Così, questi coloranti possono essere usati come indicatori del metabolismo, e quindi di vitalità cellulare.
Colorante fluorescente PER CROMATINA - ioduro di propidio ( PI )
Ioduro di propidio è un acido nucleico membrana non permeabile. Il colorante è comunemente usato per colorare selettivamente le cellule morte in una popolazione cellulare e anche usato come contrasto per i nuclei nel Multicolor Fluorescence Imaging.
Indicatore di fluorescenza dei batteri - Floxina B
Floxina B, un colorante acido rosso, è un derivato della fluoresceina con una tonalità nettamente bluastra, utilizzato per la disinfezione di acque reflue attraverso foto-ossidazione ( si lega ai batteri ). E 'usato come intermediario per la produzione di tinture fotosensibili e farmaci. Viene utilizzato anche come colorante del citoplasma in istologia. Floxina colora batteri in campioni misti. Floxina decade facilmente.
Pareti cellulari di PIANTE e FUNGHI
La parete cellulare di questi organismi consiste del polimero di glucani . Il glucano trovato nelle pareti delle cellule vegetali è la cellulosa. Il glucano trovato nei funghi è la chitina. Cellulosa e chitina non sono originariamente fluorescenti , tuttavia i fluorocromi Calcofluor e Arancio di Acridina possono essere usati per localizzare e identificare questi componenti e, indirettamente, le pareti cellulari.
LIPIDI
Tutti gli organismi viventi contengono lipidi ( di solito incamerati all'interno di organelli ). I Lipidi generalmente non emettono Fluorescenza, tuttavia questi componenti possono diventare fluorescenti utilizzando il fluorocromo Nile Red. Questo colorante è lipofilo e sarà quindi localizzato negli organelli contenenti lipidi ( liposomi ) nelle cellule. Quando eccitato dalla luce blu, Nile Red reagisce in giallo/oro.
IDENTIFICAZIONE DI BATTERI NELLA PREPARAZIONE DI CELLULE EUCARIOTICHE
Le cellule eucariotiche ( animali e vegetali ) possono essere utilizzati per ottenere una familiarità con la morfologia, la capacità di colorazione e la dimensione delle cellule batteriche. Queste cellule hanno DNA contenente nuclei , così DAPI e / o PI sono buoni flurocromi da utilizzare. Questi coloranti possono anche essere utilizzati per identificare le cellule dei batteri nella zona circostante.
IDENTIFICAZIONE DEI BATTERI UTILIZZANDO UN PARTICOLARE FLUOROCROMO
Uno dei test iniziali in un'indagine di un campione sconosciuto è quello di determinare la presenza di batteri. La marcatura fluorescente per DNA è un metodo positivo che aiuta a identificare la presenza di batteri. I fluorocromi molecolari (SYTOBC, B - 7277) sono dei coloranti di acido nucleico ad alta affinità che penetrano facilmente sia su batteri gram positivi che gram –negativi; il risultato è un segnale fluorescente verde eccezionalmente brillante. Il kit della Molecular Probes è progettato per l'analisi citofluorimetrica delle popolazioni batteriche, quindi, il colorante SYTO BC è molto utile per indagini in microscopia.I criteri utilizzati per l'identificazione microscopica dei procarioti comprendono la forma delle cellule, le loro dimensioni, il raggruppamento, la reazione Gram -, e la motilità. Le cellule batteriche quasi sempre assumono una delle tre forme: asta ( Bacillus ), sfera ( cocco ), o spirale ( spirilla e spirochete ).
I Bacilli si possono rintracciare in forme singole o in catene di cellule; i cocchi in catene ( streptococchi ) o grappoli (stafilococchi ); le cellule a forma di spirale sono quasi sempre mobili; i cocchi quasi sempre immobili.
La tabella seguente indica i risultati ottenuti mediante l'utilizzo di diversi set di filtri per ogni preparato. Per ogni test effettuato viene indicata la tipologia del set (Dualband o single band), la banda di eccitazione e di emissione del filtro, il risultato ottenuto sui vari componenti e non della cellula presa in esame. Sono stati presi in considerazione alcune delle principali parti costitutive della cellula, e, comunque quelle che fornivano maggiori garanzie di marcatura: nucleo, citoplasma, mitocondri, lisosomi, centrosomi, microtubuli, actina. Fanno parte del test, come componenti esterni, i batteri. Il colore evidenziato nella descrizione del componente è quello ottenuto dal componente stesso nella fase del test. Il valore assegnato, indica quanto è risultato appropriato l'utilizzo di quel set di filtri su quel tipo di campione e utilizzando quel determinato fluorocromo. Il valore più alto indica il miglior risultato.
FLUOROCROMO |
EXC |
EMIT |
RISULTATO DEI TEST SU CELLULE EPITELIALI UMANE IN BASE AL SET DI FILTRI USATI |
HOECHST 3258 |
346 |
460 |
B/R = Nucleo, Lisosomi, Citoplasma, Microtubuli, Batteri, R=5 |
Acridine Orange (+RNA) |
460 |
650 |
G/R => Nucleo , Lisosomi, Citoplasma, Microtubuli, Batteri, R=5 |
BO (Thiazole Yellow) |
460 |
480 |
G/R => Nucleo, Lisosomi, Citoplasma, Batteri, R=5 |
BOBO-1 |
462 |
481 |
G/R => Nucleo, Lisosomi, Citoplasma, Centrosomi, Microtubuli, Batter, R=5
|
Dye 307 |
485 |
590 |
G/R => Nucleo, Lisosomi, Citoplasma, Centrosomi, Microtubuli, Batteri, R=4
|
Nile Red (Phenoxazone 9) |
485 |
525 |
G/R => Nucleo,Vacuoli, Citoplasma, Mitocondri, R=3 |
Fluorescein (FITC) |
494 |
518 |
FITC => Nucleo, Citoplasma, Vacuoli, Actina, R=3 |
Carboxyfluorescein |
492 |
518 |
|
Acridyne Orange (+DNA) |
500 |
526 |
G/R => Nucleo, Lisosomi, Citoplasma, Microtubuli, Batteri, R=5
|
Rhodamine G |
502 |
527 |
|
TOTO-1 |
509 |
533 |
G/R => Nucleo, Lisosomi, Citoplasma, Centrosomi, Microtubuli, Batteri, R=5
|
Thiazole Orange |
509 |
530 |
G/R => Nucleo, Lisosomi , Citoplasma, Centrosomi, Microtubuli, Batteri, R=4
|
Heptyl-thiazole Orange |
515 |
535 |
|
N-desmethyl- thiazole Orange |
515 |
535 |
|
Carboxyeosin |
515 |
542 |
|
EOSIN |
524 |
544 |
G/R => Nucleo, Mitocondri, Citoplasma, Microtubuli, R=3 |
Erythrosin |
529 |
544 |
G/R => Nucleo,Vacuoli, Citoplasma, R=2 |
Rhodamine B |
555 |
580 |
|
Carboxyrhodamine B |
556 |
581 |
|
P2 (Pyrylium) |
580 |
640 |
G/R => Nucleo, Lisosomi, Citoplasma, Centrosomi, Microtubuli, Batteri , R=4
|
G/R Dualband ..................B/R Dualband...............DAPI...............................FITC...............................TRITC
EXC 490 EMI 528...............EXC 390 EMI 470...........EXC 330 EMI 450................EXC 485 EMI 535................EXC 535 EMI 590
EXC 577 EMI 633...............EXC 520 EMI 590
Menu di sezione:
- Descrizione
- Diascopia
- Epi-Fluoresc.
- Illuminazione
- Installing and Aligning a Mercury Lamp
- I Fluorocromi
- Tabella dei Fluorocromi
- Il Fading
- Lunghezze d'onda
- Proprietà
- Percentuale di Trasmissione
- Tipo di Filtri
- Sovrapposizione di banda
- Intensità del segnale
- Acquisizione di immagini
- Il set di filtri
- I Filtri
- Preparazione dei Fluorocromi
- Preparazione dei campioni
- Preparati in Fluorescenza ←
- Fluorescenza in Citochimica
- Autofluorescenza
- Immagini